Giorgia Renga, Università degli Studi di Perugia
Borsa di Studio triennale
Studio sulla Celiachia
Area: Infiammazione
Scheda dello Studio
- Numero del Finanziamento (Grant): FC 008/2018
- Titolo: Studio della interazione tra mastociti e Candida albicans nello sviluppo della celiachia.
- Area Scientifica: Infiammazione
- Durata: Progetto Triennale
- Ricercatore Titolare: Dott.ssa Giorgia Renga, Università degli Studi di Perugia, Dipartimento di Medicina e Chirurgia, Perugia
- Tutor (Capo Laboratorio): Prof.ssa Luigina Romani, Università degli Studi di Perugia, Dipartimento di Medicina e Chirurgia, Perugia.
- Collaborazioni: Dr.ssa Valeria Villella, European Institute for Research in Cystic Fibrosis (IERFC), Ospedale San Raffaele, Milano, e INMI IRCCS L. Spallanzani, Roma
Pubblicazioni:
Lo studio
Cosa si è voluto studiare e perché?
Candida albicans è un fungo che vive come commensale in equilibrio con altri microorganismi e che colonizza abitualmente le mucose umane senza provocare danno all’ospite. Il fungo è caratterizzato da una morfologia variabile, in cui si passa dalla forma sferica di lievito alla forma filamentosa di ifa. La forma ifale è considerata la forma patogena di Candida perché in grado di penetrare l’epitelio e causare danni. Tutte le condizioni che portano alla modifica del microambiente mucosale, quali antibiotici, disregolazioni metaboliche o immunologiche, sono in grado di favorire la transizione da lievito ad ifa aumentando la patogenicità del fungo. Nonostante Candida possa contribuire allo sviluppo di alcune patologie intestinali e potenzialmente favorire la comparsa di intolleranze alimentari ed allergie, il suo ruolo nella celiachia non è stato ancora approfondito. Da un lato, la presenza nella celiachia di un microambiente infiammatorio, costituito da un microbiota alterato ed altrettanta alterata permeabilità intestinale, favorisce la virulenza del fungo. Dall’altro, la scoperta, nel 2003, dell’elevata omologia tra la proteina HWP-1, localizzata sulla superficie della forma ifale di Candida, e alcune proteine del glutine responsabili della risposta infiammatoria nella celiachia, ha condotto alcuni scienziati ad ipotizzare che Candida possa contribuire alla patogenesi di celiachia (Figura 1).

Figura 1. Nel soggetto sano si ha un ambiente in equilibrio in cui il microbiota protegge la mucosa dai microrganismi potenzialmente pericolosi come Candida albicans. In questa condizione, Candida si trova sotto forma di lievito e non rappresenta una minaccia. Quando un soggetto sano mangia glutine non si genera una reazione infiammatoria ma si mantiene uno stato di tolleranza. Al contrario, in un soggetto celiaco dove la mucosa è danneggiata ed il microbiota intestinale alterato, Candida diventa minacciosa e si trova in forma di ifa, pericolosa perché in grado di penetrare gli epiteli e danneggiare le cellule. In questa condizione, Candida esprime sulla sua superficie la proteina HWP-1 che è molto simile al glutine. Attraverso questo elemento, Candida riesce a “mimare” il glutine e a confondere il sistema immunitario che la attaccherà generando una risposta infiammatoria amplificata.
Recentemente abbiamo dimostrato l’esistenza di una stretta interazione tra Candida e particolari tipi cellulari del sistema immunitario chiamati mastociti. I mastociti sono coinvolti in diverse patologie gastro-enteriche perché, rilasciando il contenuto dei granuli al loro interno in condizioni infiammatorie, sono in grado di aumentare la permeabilità intestinale ed indurre infiammazione. Gli obiettivi principali di questo progetto sono stati quelli di comprendere se e come l’interazione tra Candida e mastociti potesse influenzare lo sviluppo della celiachia e come contrastarla ai fini terapeutici.
La Metodologia
Il progetto ha previsto l’allestimento di: 1) Modelli cellulari. Sono state utilizzate cellule intestinali umane e mastociti prelevati da topi. Le cellule sono state trattate con le proteine del glutine e Candida. 2) Modelli murini. Sono stati utilizzati topi sensibilizzati con il glutine ed infettati con Candida. In entrambi i modelli sono stati valutati parametri infiammatori ed immunologici. Inoltre è stato valutato anche l’effetto in topi celiaci dell’uso di diverse molecole, quali l’indolo-3-aldeide (3-IAld) e l’anticorpo neutralizzante interleuchina (IL)-9 (aIL-9) che, pur con meccanismi diversi, sono note per interferire e contrastare l’attività di mastociti e cellule epiteliali a livello intestinale.
Quali Risultati e Quali Conclusioni?
Nella prima parte del progetto abbiamo dimostrato che le proteine del glutine rendono C. albicans molto più pericolosa in quanto, non solo favoriscono la transizione lievito-ifa, ma determinano ife più lunghe ed aumentano il numero di proteine HWP-1 sulla superficie del fungo. Il glutine è così capace di modificare la morfologia di Candida ed influenzarne le sue caratteristiche. L’aumentata virulenza di Candida in presenza di glutine è stata osservata anche in cellule intestinali umane che, a fronte del danno, rilasciano nell’ambiente maggiori quantità di IL-15, citochina responsabile di danno epiteliale. I risultati ottenuti in vitro sono stati confermati da studi in vivo in topi trattati per via orale con il glutine dopo dieta gluten-free e successivamente infettati con Candida. I risultati ottenuti hanno mostrato come Candida sia stata in grado di aumentare il danno tissutale nei topi celiaci incrementando la produzione di citochine infiammatorie. Andando a valutare il possibile coinvolgimento dei mastociti, si è osservato che in presenza di Candida aumentava la quantità di MCPT-1, molecola capace di aumentare la permeabilità intestinale, e di IL-9, citochina prodotta dagli stessi mastociti per richiamarne altri nel sito danneggiato. Questi risultati hanno dimostrato che l’asse Candida-mastociti amplifica ulteriormente la risposta infiammatoria tipica della celiachia. Nell’ultima parte del progetto abbiamo valutato l’effetto dell’uso di trattamenti volti a bloccare i mastociti infiammatori ed abbiamo visto che sia aIL-9 che 3-IAld sono stati capaci di ridurre l’infiammazione e migliorare il danno intestinale. In particolare, 3-IAld è stata capace di ridurre la transizione lievito-ifa di Candida, inibire l’attività infiammatoria dei mastociti e aumentare la quantità di batteri protettivi in modo da rinforzare la barriera intestinale (Figura 2).
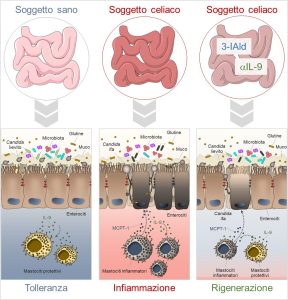
Figura 2. Nel soggetto celiaco i mastociti infiammatori, attraverso la produzione di MCPT-1 e IL-9, generano un ambiente infiammatorio promotore della virulenza di Candida. La somministrazione di 3-IAld o la neutralizzazione di IL-9, riesce a modificare il microambiente, riducendo la produzione mastocitaria di MCPT-1, favorendo il commensalismo del fungo e promovendo un microbiota intestinale protettivo.
Quali prospettive e quali benefici per i pazienti celiaci?
Il nostro studio ha dimostrato come Candida, microrganismo commensale normalmente innocuo per il nostro intestino, possa rivelarsi una minaccia in ambiente infiammatorio come quello della celiachia. La presenza di un microbiota intestinale alterato e di cellule dell’immunità come i mastociti capaci di rilasciare grandi quantità di molecole infiammatorie, creano le condizioni favorevoli all’incremento della virulenza del fungo contribuendo così ad amplificare la patologia infiammatoria intestinale. L’utilizzo di farmaci “intelligenti” che vadano non solo ad agire sul fungo, come gli antifungini, ma anche sull’ambiente infiammatorio circostante, ripristinando la corretta composizione microbica e rafforzando l’epitelio intestinale, possono fornire indicazione per nuove strategie terapeutiche.
Eventuali sviluppi futuri del progetto
Poiché i dati ottenuti in questo progetto sono stati condotti in modelli cellulari in vitro e murini in vivo, lo sviluppo logico ed auspicabile del progetto sarebbe quello di estendere i dati ottenuti nella “real-life” e cioè direttamente nel soggetto celiaco. Da qualche anno il mondo della ricerca sta cercando di sviluppare in laboratorio dei “mini-organi” capaci di mimare anatomia e funzionalità degli organi umani. Sarebbe molto interessante utilizzare le biopsie di soggetti celiaci per generare organoidi intestinali utili a definire il comportamento di mastociti e Candida nel paziente nonché una possibile stratificazione dei pazienti sulla base del loro microambiente intestinale.
Legenda
Commensale: microrganismo che normalmente risiede in un organismo ospite al quale non causa alcun danno. La pelle e le mucose dell’uomo sono colonizzate da microrganismi commensali, che proteggono dai microrganismi patogeni.
Lievito: è la forma arrotondata o ovoidale che Candida assume quando si trova sotto forma di commensale. In questa morfologia Candida vive in simbiosi con il nostro organismo.
Ifa: è la forma allungata che Candida assume quando diventa patogena. In questa morfologia Candida riesce a penetrare tra le cellule epiteliali del nostro intestino e a danneggiarle.
Virulenza: la capacità di un microrganismo di creare un danno. È geneticamente determinata e può essere legata alla capacità di invadere i tessuti da parte del microrganismo, o di produrre sostanze tossiche.
Microbiota intestinale: è l’insieme di tutti i microrganismi residenti nell’intestino e a cui ci si riferisce anche con il termine di “flora intestinale”. Il microbiota intestinale contiene milioni di microrganismi, appartenenti a centinaia di specie diverse, come batteri, funghi o virus, che vivono in equilibrio tra loro. Quando ci sono fattori che influenzano la composizione del microbiota, come stress, antibiotici, variazioni ormonali o immunologiche, diminuiscono le specie microbiche protettive ed aumentano quelle infiammatorie. Si generano così degli squilibri che possono provocare danni alla mucosa intestinale.
Proteina HWP-1: è una proteina localizzata sulla superficie di Candida solo quando si trova nella forma ifale. Gli scienziati hanno scoperto che la proteina HWP-1 ha una somiglianza del 99% con alcune proteine del glutine. Il fatto che Candida “mimi” il glutine, fa sì che il sistema immunitario si confonda e percepisca il fungo come fosse il glutine innescando così una risposta infiammatoria.
Mastociti: sono cellule del sistema immunitario che fanno parte delle prime linee di difesa di una risposta immunitaria nei confronti di un microrganismo patogeno. Possono essere protettivi o infiammatori. Quelli infiammatori sono ricchi di granuli al loro interno che contengono sostanze allergiche ed infiammatorie come MCPT-1, implicato nell’aumento della permeabilità delle cellule epiteliali in alcune patologie intestinali. L’aumento della permeabilità tra le cellule, favorisce il passaggio di microrganismi dannosi o di alimenti come il glutine che provocano infiammazione. I mastociti sono capaci anche di produrre una molecola chiamata IL-9 che ha la funzione principale di richiamare altri mastociti nei siti danneggiati amplificando così la loro attività infiammatoria.
Indolo-3-aldeide (3-IAld): è un prodotto generato a partire dal triptofano, un aminoacido essenziale che non è sintetizzato dall’organismo ma che viene assimilato solo attraverso la dieta. Una dieta ricca di banane, cioccolata fondente, uova e spinaci aumenta i livelli di triptofano il quale può essere metabolizzato generando diversi metaboliti. Tra i metaboliti prodotti ci sono gli indoli, di cui 3-IAld fa parte, che vengono metabolizzati grazie all’intervento di batteri presenti nel nostro intestino.
Anticorpo neutralizzante: molecola che legandosi ad un bersaglio blocca il suo effetto biologico.
Citochina: molecola proteica prodotta dalle cellule del sistema immunitario. La sua azione di solito è locale, ma talvolta può manifestarsi sistemicamente su tutto l’organismo.
studio in corso
studio concluso
