studio concluso
Federica Ricci, Università degli Studi di Firenze
Borsa di Studio triennale
Studio sulla Celiachia
Area: Immunologia
Scheda dello Studio
- Numero del Finanziamento (Grant): FC 007/2016
- Titolo: Caratterizzazione funzionale del microbiota intestinale e della risposta immune associata in pazienti affetti da “Celiachia Potenziale”
- Area Scientifica: Immunologia
- Durata: Progetto Triennale
- Ricercatore Titolare: Dott.ssa Federica Ricci, Dipartimento di Scienze Biomediche Sperimentali e Cliniche “Mario Serio”, Università degli Studi di Firenze
- Tutor (Capo Laboratorio): Professor Antonino Salvatore Calabrò, Dipartimento di Scienze Biomediche Sperimentali e Cliniche “Mario Serio”, Università degli Studi di Firenze
Pubblicazioni originate dal Grant:
- Niccolai E, Baldi S, Ricci F, Russo E, Nannini G, Menicatti M, Poli G, Taddei A, Bartolucci G, Calabrò AS, Stingo FC, Amedei A. Evaluation and comparison of short chain fatty acids composition in gut diseases. World J Gastroenterol. 2019 Sep 28; 25(36):5543-5558.
doi: 10.3748/wjg.v25.i36.5543. PMID: 31576099. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6767983
- Baldi S, Menicatti M, Nannini G, Niccolai E, Russo E, Ricci F, Pallecchi M, Romano F, Pedone M, Poli G, Renzi D, Taddei A, Calabrò AS, Stingo FC, Bartolucci G, Amedei A. Free Fatty Acids Signature in Human Intestinal Disorders: Significant Association between Butyric Acid and Celiac Disease. Nutrients. 2021 Feb 26; 13(3):742.
doi: 10.3390/nu13030742. PMID:33652681.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7996737
Pubblicazioni Post-Grant
- Federica R, Edda R, Daniela R, Simone B, Giulia N, Gabriele L, Marta M, Marco P, Gianluca B, Elena N, Matteo C, Serena S, Matteo R, Amedeo A, Salvatore CA. Characterization of the “gut microbiota-immunity axis” and microbial lipid metabolites in atrophic and potential celiac disease. Front Microbiol. 2022 Sep 30;13:886008. doi: 10.3389/fmicb.2022.886008. PMID: 36246269; PMCID: PMC9561818. https://pubmed.ncbi.nlm.nih.gov/36246269/
LO STUDIO
Cosa si è voluto studiare e perché?
La malattia celiaca (MC) è un’enteropatia cronica immuno-mediata innescata dal glutine in individui geneticamente predisposti. Nonostante il glutine e la predisposizione genetica, che vede coinvolti i geni DQ2 e/o DQ8 legati al sistema maggiore di istocompatibilità HLA, siano elementi necessari per lo sviluppo della MC, da soli non sono sufficienti per generarla. Infatti, il 30% della popolazione presenta i geni predisponenti ma soltanto nel 3% di loro insorge la malattia: tale dato genera l’ipotesi di un quadro patologico multifattoriale complesso alla base della celiachia (Figura 1). Dal punto di vista clinico, la MC si presenta molto eterogenea e si riscontrano manifestazioni cliniche che variano da forme completamente asintomatiche a forme con segni e sintomi di malassorbimento globale. La forma clinica più frequente è la MC conclamata che è caratterizzata dalla presenza di geni predisponenti alla malattia, dalla presenza a livello ematico di anticorpi specifici, da infiammazione intestinale accompagnata da atrofia dei villi. Esiste una forma clinica di celiachia, definita malattia celiaca potenziale (MCP), caratterizzata dalla presenza degli anticorpi specifici per la MC conclamata, dalla presenza dei geni predisponenti alla malattia e da assenza di alterazioni istologiche a carico della mucosa intestinale. I pazienti con MCP possono essere sintomatici o asintomatici e, se lasciati a dieta libera, possono nell’arco della loro vita sviluppare la MC conclamata. Ad oggi, i meccanismi regolatori alla base dell’insorgenza del danno intestinale nei pazienti con MCP sono ancora poco chiari. Per fare chiarezza su di essi, lo scopo dello studio è stato quello di caratterizzare la risposta immunitaria adattativa ed il microbiota intestinale in pazienti con MC e MCP.
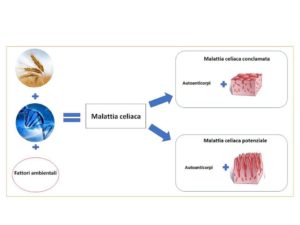
FIGURA 1: Immagine rappresentativa delle due forme cliniche di celiachia valutate nello studio.
La Metodologia
Nello studio sono stati arruolati pazienti con MC, con MCP e soggetti sani. Sono stati raccolti campioni bioptici intestinali appartenenti ai pazienti e campioni fecali appartenenti ai pazienti e ai soggetti sani. Dai campioni bioptici intestinali sono stati isolati i linfociti T ed il materiale genetico appartenente ai batteri adesi alla mucosa intestinale; dai campioni fecali è stato isolato il materiale genetico appartenente al microbiota fecale. I linfociti T sono stati analizzati dal punto di vista fenotipico tramite citofluorimetria a flusso e dal punto di vista funzionale tramite test ELISA mentre il materiale genetico appartenente ai batteri adesi alla mucosa ed ai batteri
fecali è stato estratto tramite DNeasy PowerLyzer PowerSoil Kit e analizzato tramite tecnologia Next Generation Sequencing.
Quali Risultati e quali conclusioni?
L’analisi immunologica effettuata sulle biopsie intestinali dei pazienti con MC e MCP, ha permesso di identificare differenze tra i due gruppi (dati in fase di preparazione per pubblicazione scientifica).
Rispetto al tessuto intestinale dei pazienti con MC, nel tessuto dei pazienti con MCP è stata riscontrata una percentuale minore di linfociti CD4+, assenza di linfociti con TCR γδ, un aumento di linfociti CD4+ producenti IL-17 e di linfociti CD4+ producenti IL-10, una diminuzione di linfociti CD4+ producenti IL-4 e di linfociti CD4+ co-producenti IFN-γ e IL-17.
Nei pazienti con MCP, la minore percentuale di linfociti CD4+ (che hanno un ruolo chiave nella risposta infiammatoria innescata dal glutine) e l’assenza di linfociti γδ (che hanno un ruolo infiammatorio), ci ha fatto ipotizzare la presenza di una risposta immunitaria al glutine più debole.
Inoltre, l’ aumento dei linfociti producenti IL-17 (citochina a cui numerosi studi attribuiscono un ruolo preventivo nei confronti dell’infiammazione della mucosa intestinale) e dei linfociti producenti IL-10 (citochina a cui viene attribuito un ruolo immunoregolatorio) potrebbe tenere a freno l’infiammazione intestinale e contribuire così a prevenire il danno alla mucosa. Le sottopopolazioni linfocitarie producenti IL-4 e co-producenti IFN-γ/IL-17 sono coinvolte nel danno alla mucosa intestinale nei pazienti con MC e, per tale motivo, abbiamo ipotizzato che la loro diminuzione nei tessuti dei pazienti con MCP possa anch’essa contribuire a prevenire l’insorgenza del danno intestinale.
L’analisi microbiologica effettuata sulle biopsie intestinali dei pazienti con MC e MCP, non ha evidenziato taxa microbici statisticamente diversi nei due gruppi suggerendo l’esistenza della stessa architettura microbica tissutale in entrambe le condizioni (dati in fasi di preparazione per pubblicazione scientifica).
L’analisi microbiologica effettuata sui campioni fecali dei pazienti e dei soggetti sani è ancora in corso.
Quali prospettive e quali benefici per I pazienti celiaci?
Attualmente, nella comunità scientifica, ci sono pareri contrastanti a riguardo dell’applicazione della dieta aglutinata in tutti i pazienti con MCP. A causa degli scarsi dati relativi ai meccanismi regolatori alla base dell’insorgenza del danno intestinale, è davvero difficile comprendere quali siano i pazienti che hanno bisogno della terapia imminente e quelli che possono continuare ad assumere glutine senza sviluppare danni. Approfondendo i risultati ottenuti dallo studio, potremmo individuare possibili biomarcatori che ci permetterebbero di identificare tra i pazienti con MCP quelli dove il rischio di sviluppare la malattia celiaca conclamata è imminente.
Eventuali sviluppi futuri del progetto:
Sarebbe molto interessante poter mantenere a dieta libera i pazienti con MCP arruolati nello studio in modo da poter effettuare nel tempo nuovi campionamenti che permetterebbero di individuare cambiamenti immunologici e/o microbiologici predittivi l’insorgenza del danno. Inoltre, l’assenza di differenze a carico dei batteri adesi alla mucosa intestinale dei pazienti con MC e MCP merita un approfondimento: una composizione stabile del microbiota nei tessuti intestinali non esclude differenze a carico dell’attività metabolica dei batteri presenti e, per tale motivo, merita effettuare la valutazione degli SCFA.
Legenda:
Linfociti T: cellule del sistema immunitario capaci di riconoscere un antigene quando è esposto sulla superficie di cellule dette cellule presentanti l’antigene. In base all’espressione a livello della membrana cellulare del recettore CD4 o del recettore CD8 si dividono in: linfociti T helper (CD4+) e linfociti T citotossici (CD8+). In base alla produzione di citochine (proteine di piccole dimensioni che mediano le interazioni cellulari), i linfociti T si dividono in tante sottopopolazioni che possono svolgere funzioni di tipo infiammatorio o antinfiammatorio.
TCR: recettore presente sulla membrana cellulare dei linfociti T responsabile del riconoscimento degli antigeni presentati dal complesso maggiore di istocompatibilità.
Microbiota fecale: batteri presenti nelle feci.
Citofluorimetria a flusso: metodologia che permette di valutare i parametri cellulari.
Test ELISA: metodologia che permette di rilevare e/o dosare la presenza di proteine, anticorpi o antigeni all’interno di un campione.
DNeasy PowerLyzer PowerSoil Kit: kit che permette di estrarre il materiale genetico.
Next Generation Sequencing: tecnologie che permettono di ottenere la sequenza di grandi genomi in tempi brevi.
Biomarcatore: indicatore di uno stato biologico che può dunque essere correlato con l’insorgenza o lo sviluppo di una patologia.
SCFA: acidi grassi a catena corta prodotti attraverso la fermentazione batterica delle fibre alimentari.
